Zdecydowana większość chorób przyzębia jest zaliczana do bakteryjnych stanów zapalnych obejmujących początkowo tkanki dziąsła, a następnie, w miarę rozwoju choroby: ozębną, kość wyrostka zębodołowego oraz cement korzeniowy zębów. Przeprowadzone na zlecenie Ministerstwa Zdrowia badania epidemiologiczne w Polsce wykazały, że wśród dzieci i młodzieży w wieku 12 lat zdrowe przyzębie stwierdzono jedynie u 47,3% badanych, w grupie młodzieży 18-letniej – u 37,3% pacjentów, natomiast zaawansowana choroba przyzębia występowała już u 0,5% młodzieży. Natomiast u dorosłych Polaków w wieku 35–44 lat zaledwie 1% pacjentów nie ma żadnych objawów periodontologicznych, a u ponad 16% osób jest rozpoznawane zaawansowane zapalenie przyzębia (głębokość pomiarowa kieszonek PD >5 mm).
POLECAMY
Objawy kliniczne chorób przyzębia
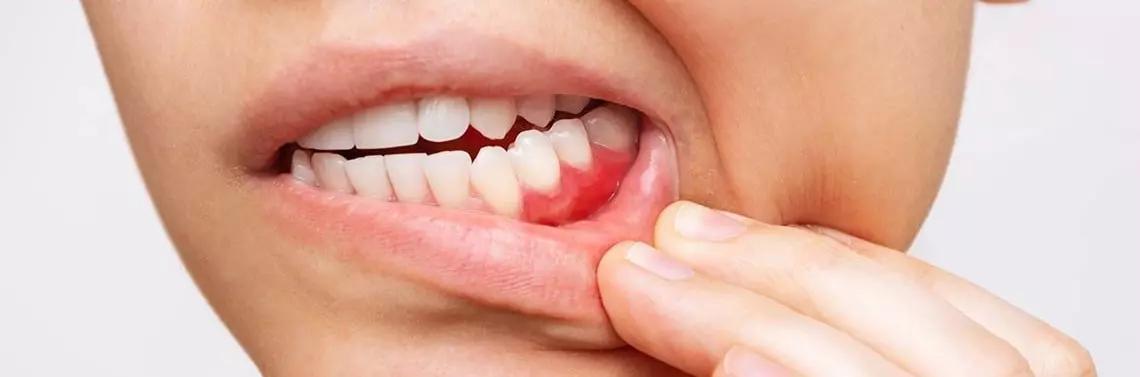
Początkowe objawy są typowe dla zapaleń dziąseł. Zalicza się do nich: krwawienie z dziąseł przy sondowaniu (BoP >10%), ich zaczerwienienie, obrzęk, rozpulchnienie i nieprzyjemny zapach z ust (fetor ex ore) oraz ostatecznie występowanie kieszeni dziąsłowych (PD >3 mm). Kolejne objawy, które mogą się pojawić, są typowe dla zapaleń przyzębia:
- utrata kości wyrostka zębodołowego (BL >15%),
- destrukcja przyczepu łącznotkankowego (CAL >2 mm) przy co najmniej dwóch niesąsiadujących zębach,
- wydłużanie się koron klinicznych zębów,
- pojawianie się furkacji,
- przemieszczanie się zębów, ich wychylanie się, rozchwianie, a ostatecznie ich utrata.
Pierwsze objawy zapalenia dziąseł pojawiają się wraz z gromadzeniem się i dojrzewaniem bakteryjnego biofilmu nazębnego, co może być związane z nieprawidłowym szczotkowaniem zębów lub jego zaniechaniem przez co najmniej trzy dni, a także np. z nieoczyszczaniem przestrzeni międzyzębowych. Występowanie złogów kamienia nazębnego stanowi ważne miejsce retencji dla biofilmu bakteryjnego i nasila objawy zapalne.
Zapalenie przyzębia nie stanowi naturalnej konsekwencji nieleczonego zapalenia dziąseł, lecz rozwija się wskutek zaburzenia równowagi patogen–układ odpornościowy gospodarza w wyniku osłabienia odporności immunologicznej chorych spowodowanej, np. starszym wiekiem, czynnikiem genetycznym, paleniem tytoniu, cukrzycą, otyłością, stresem, osteoporozą, przyjmowaniem niektórych leków (np. blokerów kanałów wapniowych, immunosupresyjnych), niewłaściwymi nawykami żywieniowymi czy ruchowymi, AIDS i innymi chorobami towarzyszącymi.
Etiologia
Zapalenie dziąseł (gingivitis) (zdj. 1) jest nieswoistą reakcją na wzrost liczby bakterii (zarówno Gram-dodatnich, jak i Gram-ujemnych) występujących w szczelinie dziąsłowej. Natomiast zapalenie przyzębia jest związane z namnażaniem się pewnych gatunków bakterii Gram-ujemnych w szczelinach dziąsłowych. Efektem jest tworzenie się kieszonki przyzębnej, co sprzyja jeszcze większemu gromadzeniu się bakterii oraz powoduje zmianę składu mikrobioty. Płytka naddziąsłowa (biofilm) u ludzi ze zdrowymi dziąsłami składa się z kilku–kilkunastu (1–20) warstw komórek ziarniaków Gram-dodatnich (Streptococcus mutans, S. mitis, S. sanguis, S. oralis, Rothia dentocariosa) oraz pałeczek Gram-dodatnich (Actinomyces viscosus, A. israelii, A. gerencseriae, Corynebacterium spp.) i nielicznych ziarniaków Gram-ujemnych (Veillonella parvula, Neisseria spp.).

Biofilmy występujące u osób z zapaleniem przyzębia są najczęściej poddziąsłowe, charakteryzują się złożoną, wielowarstwową budową. Skład populacji bakteryjnej w czynnej, agresywnej fazie choroby różni się od składu w okresie remisji. Dominacja bakterii z gatunków Tannerella forsythia, Treponema denticola, Porphyromonas gingivalis, Prevotella intermedia i Campylobacter rectus wiąże się z większą głębokością kieszonek przyzębnych (od 4 mm wzwyż) oraz krwawieniem przy badaniu sondą periodontologiczną (BoP). Oprócz wymienionych gatunków bakterii można stwierdzić obecność innych beztlenowców Gram-ujemnych, takich jak Aggregatibacter actinomycetemcomitans, Fusobacterium nucleatum, Eikenella corrodens.
W obecnie obowiązującym modelu wieloczynnikowej patogenezy zapalenia przyzębia według Chapple (ryc. 1) szczególną uwagę zwraca się na odpowiedź immunologiczno-zapalną gospodarza stanowiącą główny czynnik indukujący powstanie biofilmu dysbiotycznego w kieszonkach przyzębnych. Za przejście wczesnego zapalenia dziąseł w ustabilizowane zapalenie dziąseł, a następnie w zapalenie przyzębia odpowiada zmiana odpowiedzi immunologiczno-zapalnej z adekwatnej, kontrolującej nawet obfitą biomasę biofilmu bakteryjnego znajdującego się w kieszonce w nadmierną, niebędącą w stanie kontrolować oddziaływania dysbiotycznego biofilmu nazębnego na organizm gospodarza. Patogeneza zapalenia przyzębia nie dotyczy tylko interakcji bakteryjno-zapalnych, czyli biofilm bakteryjny–układ odpornościowy. Ważne zmiany zachodzą również w transkryptonach (mRNA), proteomach i metabolomach płynu dziąsłowego oraz śliny. Model ten stanowi ważny punkt odniesienia w indywidualnym planowaniu i modelowaniu nowoczesnej terapii periodontologicznej.

Leczenie chorób przyzębia
Na podstawie obecnie dostępnych dowodów naukowych, spełniających kryteria EBM (Evidence Based Medicine), Europejska Federacja Periodontologii (EFP) wydała zalecenia dotyczące współczesnej terapii periodontologicznej. Zalecenia te – jak zapowiada federacja – będą aktualizowane cyklicznie, co pięć lat, zgodnie z postępem wiedzy medycznej, na podstawie indeksowanego piśmiennictwa medycznego oraz opinii eksperckich.
Niezbędnym warunkiem wstępnym terapii periodontologicznej jest poinformowanie pacjenta o diagnozie, w tym o przyczynach choroby, czynnikach ryzyka, alternatywnych metodach leczenia oraz oczekiwanym ryzyku i korzyściach, w tym możliwości nieleczenia. Po tej rozmowie należy uzgodnić indywidualny plan leczenia. Może on wymagać modyfikacji w trakcie leczenia, w zależności od preferencji pacjenta, efektów leczenia niezgodnych z oczekiwaniami oraz zmianami w ogólnym stanie zdrowia.
Zalecane postępowanie lecznicze zawarto w czterech etapach.
Etap pierwszy
Etap pierwszy ma na celu ukierunkowanie zmian zachowania (behawioru) chorych na prozdrowotne poprzez motywację do skutecznego usuwania biofilmu naddziąsłowego oraz kontroli czynników ryzyka. Jego elementami są:
- interwencje mające na celu poprawę skuteczności zabiegów higienicznych jamy ustnej (wspomniana już motywacja, instruktaż oraz kontrola skuteczności podejmowanych działań),
- wspomagające leczenie chorób dziąseł, czyli profesjonalne mechaniczne usuwanie złogów nazębnych (PMPR), obejmujące usuwanie płytki bakteryjnej nad- i poddziąsłowej oraz kamienia nazębnego, a także eliminację ewentualnych występujących czynników retencyjnych dla płytki nazębnej, utrudniających przeprowadzanie prawidłowych zabiegów higienicznych,
- kontrola czynników ryzyka, która obejmuje wszystkie interwencje związane ze zmianą zachowań na prozdrowotne, eliminację lub minimalizację zidentyfikowanych czynników ryzyka chorób przyzębia (zaprzestanie palenia, lepsza kontrola metaboliczna cukrzycy, zwiększenie aktywności fizycznej, poradnictwo dietetyczne oraz zmniejszenie masy ciała, leczenie osteoporozy i in.).
Etap drugi
Etap drugi to właściwa terapia przyczynowo-skutkowa, która ma na celu opanowanie (zmniejszenie bądź eliminację) dysbiotycznego biofilmu bakteryjnego i kamienia poddziąsłowego za pomocą instrumentów do pracy poddziąsłowej. Należy uwzględnić następujące interwencje:
- zastosowanie dodatkowych środków fizycznych lub chemicznych w celu eliminacji dysbiotycznego biofilmu bakteryjnego,
- zastosowanie pomocniczych środków modulujących układ odpornościowy gospodarza (miejscowych lub ogólnoustrojowych),
- zastosowanie uzupełniających poddziąsłowych miejscowych środków przeciwbakteryjnych,
- zastosowanie wspomagających ogólnoustrojowych środków przeciwbakteryjnych.

Drugi etap terapii periodontologicznej powinien zostać przeprowadzony u wszystkich chorych z zapaleniem przyzębia, niezależnie od jego stadium zaawansowania i stopnia progresji.
W wybranych sytuacjach klinicznych, np. w przypadku obecności głębokich kieszonek, pierwszy i drugi etap terapii można przeprowadzić jednocześnie (np. w celu zapobiegania powstawaniu ropni przyzębia).
Indywidualną odpowiedź kliniczną na drugi etap terapii należy ocenić po wygojeniu tkanek przyzębia (reewaluacja). W przypadku nieosiągnięcia założonych celów przeprowadzonej terapii (obecność kieszonek o PD ≥4 mm z krwawieniem przy zgłębniku lub obecność głębokich kieszonek o PD ≥6 mm) należy rozważyć trzeci etap terapii. Jeśli leczenie zakończyło się sukcesem w osiągnięciu punktów końcowych terapii, przeprowadza się terapię podtrzymującą (etap czwarty).
Etap trzeci
Etap trzeci obejmuje leczenie tych obszarów uzębienia, które nie zareagowały właściwie na drugi etap terapii (obecność kieszonek PD ≥4 mm z krwawieniem przy sondowaniu lub obecność głębokich kieszonek przyzębnych PD ≥6 mm). Ma on na celu uzyskanie lepszego dostępu do instrumentalizacji poddziąsłowej i/lub przeprowadzenie zabiegów regeneracyjnych lub resekcyjnych przyzębia (leczenie destrukcji kości, obnażonych furkacji).
Etap ten może obejmować następujące postępowanie:
- wielokrotnie powtarzana instrumentalizacja poddziąsłowa z terapią wspomagającą lub bez niej,
- chirurgia przyzębia z uwolnieniem płata śluzówkowo-okostnowego,
- chirurgiczne zabiegi resekcyjne przyzębia,
- chirurgiczne zabiegi regeneracyjne przyzębia.
Jeżeli istnieją wskazania do interwencji chirurgicznej, powinno się na nią uzyskać dodatkową zgodę pacjenta. Należy rozważyć szczegółową ocenę czynników ryzyka chorób przyzębia, przeciwwskazań medycznych do zabiegów chirurgicznych oraz osiągnięcie dobrego stanu higieny jamy ustnej.
Po wygojeniu tkanek przyzębia należy ponownie ocenić indywidualną odpowiedź organizmu na trzeci etap leczenia (ponowna reewaluacja). Pacjentów spełniających cele terapii należy skierować do leczenia podtrzymującego. Niektóre końcowe efekty terapii mogą jeszcze nie zostać osiągnięte w przypadku wszystkich zębów u chorych z ciężkim zapaleniem przyzębia w jego trzecim stadium.
Etap czwarty
Etap czwarty to podtrzymująca terapia periodontologiczna, która ma na celu utrzymanie stabilności osiągniętych efektów leczenia przyzębia u wszystkich leczonych chorych z zapaleniem przyzębia. Łączy ona działania profilaktyczne i terapeutyczne określone w pierwszym i drugim etapie terapii, w zależności od stanu dziąseł i przyzębia pacjenta. Ta faza powinna być realizowana w regularnych odstępach czasu, zgodnie z indywidualnymi potrzebami pacjenta. Podczas każdej z wizyt kontrolnych pacjent może wymagać ponownego leczenia w przypadku wykrycia nawrotu choroby. W takich sytuacjach należy ponowić diagnostykę i zaktualizować plan leczenia. Ponadto przestrzeganie zalecanych metod postępowania dotyczących higieny jamy ustnej i zdrowego stylu życia stanowi integralną część podtrzymującej opieki periodontologicznej.
Na każdym etapie terapii periodontologicznej należy rozważyć ekstrakcje zębów, jeżeli rokowanie w ich przypadku zostanie uznane za niepomyślne.
Dyskusja
Grupy robocze ekspertów EFP jednoznacznie zarekomendowały, że na każdym etapie leczenia periodontologicznego szczególnie istotnym i wymaganym elementem jest osiągnięcie i utrzymanie właściwej higieny jamy ustnej leczonych osób. Obecnie obowiązujące rekomendacje nie wskazują jednoznacznie konkretnego rodzaju szczoteczki do mycia zębów, jakiej powinni używać pacjenci. Wybór ten powinien zostać dokonany w zgodzie z indywidualnymi potrzebami i możliwościami leczonych osób. Należy również pamiętać, że elektryczne szczoteczki do zębów (zdj. 2) mogą być uważane za skuteczną alternatywę dla szczoteczek manualnych. Wydano natomiast silną rekomendację dotyczącą konieczności stosowania u pacjentów periodontologicznych szczoteczek do przestrzeni międzyzębowych oraz w miarę możliwości unikanie nici dentystycznych.
Najnowsze badania, które ukazały się w bieżącym, 2023 r., co istotne – już po wydaniu obecnie obowiązujących rekomendacji EFP dotyczących leczenia chorób przyzębia, wskazują, że ułatwieniem w osiągnięciu właściwego, rekomendowanego poziomu higieny jamy ustnej we wszystkich etapach terapii periodontologicznej mogą być szczoteczki elektryczne.
Przegląd systematyczny i metaanaliza 38 badań klinicznych względnego wpływu na wskaźnik płytki nazębnej u dzieci i młodzieży używających szczoteczek elektrycznych wykazała wyższą redukcję płytki – o 17,2% – w przypadku pacjentów nieortodontycznych i o 13,9% w przypadku pacjentów ortodontycznych w porównaniu z osobami używającymi szczoteczek ręcznych. Wyniki te dostarczają mocnych dowodów naukowych przemawiających za zalecaniem elektrycznego szczotkowania zębów pacjentom w wieku rozwojowym, także leczonym ortodontycznie.
Opublikowano także populacyjne kohortowe badanie kliniczne prowadzone przez okres siedmiu lat wśród 2214 uczestników w wieku 20–79 lat. Jego celem było określenie długoterminowego wpływu stosowania elektrycznych szczoteczek do zębów w porównaniu ze stosowaniem szczoteczek manualnych na nasilenie zapalenia przyzębia, występowanie próchnicy zębów oraz liczbę brakujących zębów.
W badaniu tym kompleksowo dostosowano uogólnione modele liniowe i modele regresji porządkowej, które określiły pozytywny wpływ stosowania szczoteczek elektrycznych na wyniki leczenia stomatologicznego.
W czasie obserwacji użytkownicy szczoteczek elektrycznych mieli niższe mediany średniej głębokości pomiarowej kieszonek (PD = 2,21 mm) i średniego poziomu przyczepu klinicznego (CAL = 1,73 mm) niż użytkownicy szczoteczek manualnych (odpowiednio PD = 2,30 i CAL = 1,96 mm). Skorygowane modele obserwacyjne wykazały korzystny wpływ stosowania szczoteczek elektrycznych na poziom płytki nazębnej, krwawienia podczas sondowania, średnią wartość PD, odsetek miejsc z PD ≥4 mm, średni poziom przyczepu klinicznego oraz mniejszą liczbę utraconych zębów. W przypadku liczby brakujących zębów skutki były bardziej widoczne u uczestników w wieku ≥50 lat. W tym badaniu nie wykazano istotnej korelacji dotyczącej choroby próchnicowej zębów.
Wnioski
- Na każdym etapie leczenia periodontologicznego szczególnie istotnym i wymaganym elementem jest osiągnięcie i utrzymanie właściwej higieny jamy ustnej leczonych osób.
- Elektryczne szczoteczki do zębów mogą zostać uznane za skuteczną alternatywę dla szczoteczek manualnych.
- Zalecenie stosowania szczoteczek elektrycznych przez lekarzy stomatologów może się przyczynić do długoterminowej ochrony periodontologicznej zarówno u dzieci leczonych lub nieleczonych ortodontycznie, jak i u osób dorosłych.
- Istnieje silna rekomendacja kliniczna dotycząca stosowania szczoteczek do przestrzeni międzyzębowych oraz unikania w miarę możliwości stosowania nici dentystycznych u pacjentów periodontologicznych.
Piśmiennictwo
- Górska R., Pietruska M., Dembowska E. et al. Częstość występowania chorób przyzębia u osób w wieku 35–44 lat w populacji dużych aglomeracji miejskich. Dent Med Probl 2012; 49 (1): 19‑272.
- Genco R. Current view of risk factors for periodontal diseases. J Periodont 1996; 67 (10S): 1041–1049.
- Zaremba L. Choroby przyzębia a wzrost odpowiedzi zapalnej. Czas Stomatol 2009; 62 (7): 531–548.
- Górska R. Związek zapaleń przyzębia z chorobami ogólnoustrojowymi [Relationship between periodontitis and systemic disorders]. Dent Med Probl 2009; 46 (4): 379–383.
- Rivera R., Andriankaja O., Perez C. et al. Relationship between periodontal disease and asthma among overweight/obese adults. J Clin Periodontol 2016; 43 (7): 566–571.
- Kellesarian S., Kellesarian T., Ros Malignaggi V. et al. Association between periodontal disease and erectile dysfunction: a systematic review. Am J Mens Health 2016; 12 (2): 338–346.
- Chrysanthakopoulos N. Correlation between periodontal disease indices and lung cancer in Greek adults: a case-control study. Exp Oncol 2016; 38 (1): 49–53.
- Soory M. Oxidative stress induced mechanisms in the progression of periodontal diseases and cancer. Cancers 2010; 2 (2): 670–692.
- Greenstein G., Lamster I. Changing periodontal paradigms: Therapeutic implications. Int J Periodontics Restorative Dent 2000; 20 (4): 336–357.
- Steward J.E., Wager K.A., Friedlander A.H. et al. The effects of periodontal treatment on glycemic control in patients with type 2 diabetes mellitus. J Clin Periodontol 2001; 28 (4): 306–310.
- Chapple I., Genco R. Diabetes and periodontal diseases: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Clin Periodontol 2013; 40: 106–112.
- Śliz M., Olszewska-Czyż I., Kantorowicz M. et al. Zapalenie przyzębia w przebiegu cukrzycy. Przegląd Lekarski 2013; 70 (11): 958–611.
- Górska R. Choroby przyzębia – Klasyfikacja 2017. PZWL. Warszawa 2018.
- Kalala-Kazadi E., Sekele-Issouradi J.P., Bolenge-Ileboso J. et al. Periopathogenic bacteria in dental plaque of Congolese patients with periodontitis: A pilot study. J Clin Exp Dent 2018; 10 (3): 232–236.
- Alghamdi A., Almarghlani: Periodontal pathogenic bacteria among high school children in Saudi Arabia. Annals of Saudi Medicine 2019; 39 (4): 244–250.
- Wychowanski P., Szubinska-Lelonkiewicz D., Osiak M. et al. New approach to treatment of high-risk allograft recipients under chronic immunosuppression with tooth loss. Evaluation of safety and longevity of dental implants: a case report. Transplant Proc 2020: 52 (8): 2558–2562.
- Torrungruang K., Jitpakdeebordin S., Charatkulangkun O. et al. Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans, and Treponema denticola /Prevotella intermedia co-infection are associatedwith severe periodontitis in a thai population. PLoS ONE 2015; 10 (8): e0136646.
- Cortelli J.R., Cortelli S.C., Jordan S. et al. Prevalence of periodontal pathogens in Brazilians with aggressive or chronic periodontitis. Journal of Clinical Periodontology 2005; 32: 860–866.
- Chahbouni A., Filali-Maltouf E., Oum K. Aggregatibacter actinomycetemcomitans and Porphyromonas gingivalis in aggressive periodontitis in Morocco – preliminary study. Odonto-stomatologie Tropicale = Tropical Dental Journal 2013; 36: 5–10.
- Bi J., Barona Intriago M.F., Koivisto L. et al. Leukocyte- and platelet-rich fibrin regulates expression of genes related to early wound healing in human gingival fibroblasts. Cli J Per 2020; 47 (7): 851–862.
- Graves A., Grahl T., Keiserman M. et al. Systematic review and meta analysis of the relative effect on plaque index among pediatric patients using powered (electric) versus manual toothbrushes. Dent J (Basel) 2023; 11 (2): 46.
- Sager P., Kocher T., Pitchika V. et al. Powered tooth brushes are beneficial for long-term oral health: Results from the Study of Health in Pomerania (SHIP-TREND). J Clin Periodontol 2023; 50 (5): 548–558.