POLECAMY
Obecnie istnieją różne materiały kościozastępcze. Rozwój materiałoznawstwa uznał pojawienie się zęba jako doskonałe źródło materiału kostnego. Materiał pochodzenia zębowego został szczególnie przebadany jako materiał autogenny mogący pokonać niedoskonałości wszczepów alogennych, ksenogennych oraz syntetycznych, bez utraty zdolności regeneracji kości. Duża część zęba zbudowana jest z zębiny bogatej w kolagen z dużą ilością białek macierzowych i białek niekolagenowych.
Białka, takie jak białka morfogenetyczne kości i białka stymulujące wzrost, przede wszystkim modulują bioremodeling kości [1]. Stosowanie świeżo usuniętych lub dobrze zachowanych zębów zatrzymanych, a zwłaszcza ich zębiny, jest idealnym źródłem biorusztowania. W miejscu, które wymaga minimalnej ilości materiałów rusztowaniowych, takim jak ograniczony rozszczep podniebienia, dobrze uformowane zęby (np. trzecie zęby trzonowe) mogą służyć jako doskonały materiał źródłowy.
Ludzki ząb jest bogatym źródłem komórek macierzystych i czynników wzrostu [2].
Chociaż tkanki strukturalne kości i zębiny są różne, stosunek zawartości organicznej i nieorganicznej jest podobny (70% stanowią składniki mineralne, 20% kolagen i 10% płyny ustrojowe – wagowo). Zębina zawiera również pewne czynniki wzrostu wspólne dla kości, a mianowicie insulinopodobny czynnik wzrostu II, białko morfogenetyczne kości (ang. bone morphogenetic protein – BMP) i transformujący czynnik wzrostu β [3]. Zawiera również odmiany białek podobnych do kości, a mianowicie: osteopontyny, sialoproteiny kości, sialoproteiny zębiny i osteokalcynę, dzięki którym uznano je za skuteczny alternatywny materiał do przeszczepiania kości [4].
Autogenna demineralizowana matryca zębiny w praktyce stomatologicznej Yeomans i Urist po raz pierwszy udowodnili właściwości regeneracyjne autogennej demineralizowanej matrycy zębiny (ang. demineralized dentin matrix – DDM). Według Urista BMP obecny w DDM i kości jest głównym stymulantem właściwości osteoindukcyjnych.
Co więcej, udowodniono, że BMP promuje tworzenie chrząstki i kości, różnicując niezróżnicowane mezenchymalne komórki macierzyste w chondrocyty i komórki kościotwórcze [5, 6]. Uważa się, że niekolagenowe białka zębiny, takie jak osteokalcyna, osteonektyna, fosfoproteina i sialoproteina, uczestniczą w wapnieniu kości [7, 8].
Białko morfogenetyczne pochodzące z matrycy zębiny nie jest tym samym, co BMP pochodzące z matrycy kostnej, ale są one bardzo podobne i wykazują ten sam rodzaj działania w organizmie [9].
Murata i wsp. wywnioskowali, że DDM nie hamuje aktywności BMP-2 i wykazuje lepszy profil uwalniania BMP-2, a zatem ludzka DDM poddana recyklingowi jest unikalną, wchłanialną matrycą ze zdolnością do osteoindukcji. W związku z tym DDM należy uznać za skuteczny materiał wszczepowy, który jest nośnikiem BMP-2 i rusztowaniem dla komórek tworzących kości [10].
Zgodnie z analizą biochemiczną oraz histomorfometryczną kości i chrząstki indukowaną przez ludzkie DDM i BMP-2 naukowcy wywnioskowali, że ludzka DDM pochodząca z żywych zębów pobudza kość i chrząstkę oraz że BMP-2 również wzmaga i przyspiesza tworzenie kości w systemie nośnikowym DDM [11].
Na co dzień w praktyce stomatologicznej zęby są usuwane z różnych przyczyn, nie tylko ortodontycznych. Gdy pacjent dysponuje zębem przeznaczonym do ekstrakcji, można go po usunięciu skruszyć w moździerzu czy młynku kostnym bądź uformować z niego bloczki. Następnym etapem jest wyjaławianie materiału w urządzeniu BonMaker z wykorzystaniem sterylnej wody demineralizowanej oraz trzech odczynników. Proces trwa 19 min i 50 s w przypadku granulatu oraz 35 min i 50 s w przypadku bloczka. Po tym czasie materiał jest gotowy do aplikacji do zębodołu zaraz po ekstrakcji zęba lub wykorzystania w zabiegu sterowanej regeneracji kości w czasie wprowadzania implantu.
Obie postaci materiału wykazują dobrą zwilżalność roztworem soli fizjologicznej i krwią. Granulat po nasączeniu krwią z pola zabiegowego cechuje się spoistością i łatwością zastosowania. W czasie jednego procesu w urządzeniu można przygotować do 3 cm³ granulatu lub do 4 bloczków. Gotowy materiał jest wolny od nieprzereagowanych czynników.
Autogenny materiał kostny pochodzenia zębowego znajduje wiele zastosowań klinicznych. Ponieważ jest autogenny, ryzyko reakcji immunologicznej jest wyeliminowane. Może być stosowany do sterowanej regeneracji tkanek, utrzymania kości wyrostka po ekstrakcji zęba, w zabiegu podnoszenia dna zatoki, resekcji korzeni, wyłuszczania torbieli itp. [12, 13].
Kim i wsp. używał autogenicznego proszku kostnego i bloku w zębodole natychmiast po ekstrakcji zęba. Naukowcy stwierdzili dobre gojenie się zębodołu i przebudowę materiału po 3,5 miesiącu od wprowadzenia implantu [14]. Murata i wsp. wywnioskowali, że aby BMP i czynniki wzrostu zostały przyjęte jako przeszczepy kostne, potrzebny jest odpowiedni nośnik, podczas gdy inni badacze stwierdzili, że DDM jako taki może odgrywać rolę nośnika egzogennego BMP i czynników wzrostu, jak również dawać efekt osteoindukcyjny [15]. Lee i wsp. porównali skuteczność autogennego DDM z innymi materiałami do przeszczepu kości stosowanymi w operacjach podnoszenia dna zatoki szczękowej; po 4 miesiącach gojenia wystąpiło tworzenie kości, ale autogenny DDM ujawnił szybsze tempo i lepszą jakość tworzenia kości niż pozostałe materiały [16]. Podobne wyniki uzyskali Jeong i wsp. w 2011 r. podczas wykonywania zabiegu podnoszenia dna zatoki szczękowej przy użyciu materiału ATB [17]. Chang i wsp. w 2014 r. przeprowadzili sterowaną regenerację kości (ang. guided bone regeneration – GBR), a następnie umieszczenie implantu i uzupełnienie protetyczne, a wyniki wykazały, że nie ma znaczącej radiograficznie różnicy utraty kości brzeżnej bezpośrednio po zabiegu GBR, umieszczeniu implantu i osadzeniu suprastruktury [18].
Opis przypadku
Poniżej przedstawiono przykład zabiegu sterowanej regeneracji kości wspomagającej wprowadzenie implantów środkostnych.
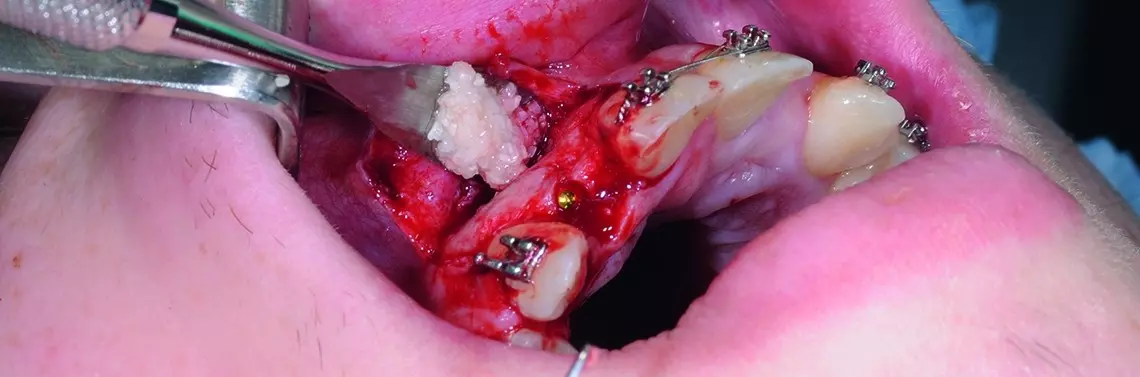
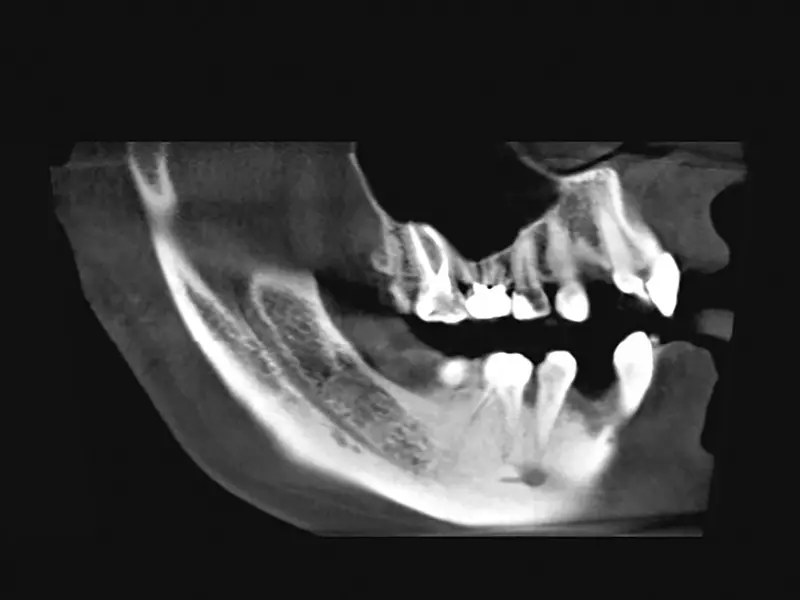
Pacjent, lat 19, leczony ortodontycznie. Ze względu na brak zawiązków zębów 12. i 22. zaplanowano leczenie implantologiczne. Biorąc pod uwagę ukształtowanie wyrostka zębodołowego w tych okolicach oraz możliwość powstania fenestracji wierzchołkowej w czasie wprowadzania implantów, przewidywano konieczność zastosowania materiału kostnego. Pacjent „dysponował” własnym materiałem kostnym w postaci dwóch zatrzymanych trzecich zębów trzonowych. Uznano, że ilość materiału pochodząca z jednego trzonowca będzie wystarczająca do zaopatrzenia obu miejsc implantacji.
Usunięto ząb 48., a następnie poddano go działaniu 3-procentowego roztworu wody utlenionej przez 3 minuty. Oczyszczono z włókien ozębnej, a następnie umieszczono na sucho w pojemniku, który był przechowywany w temperaturze 8°C do czasu zabiegu implantacji.
W dniu zabiegu ząb skruszono tak, aby uzyskać drobiny wielkości 800–1000 µm, które są optymalne dla procesu regeneracji kości. Po rozdrobnieniu otrzymano 1,5 cm³ materiału kostnego.
Autogenny materiał kostny pochodzenia zębowego umieszczono w ubytku tak, aby pokrył odsłoniętą powierzchnię implantu. Materiał po nasączeniu krwią był dostatecznie zwięzły i nie wymagał zastosowania dodatkowych membran. Po uwolnieniu okostnej pole operacyjne zostało zamknięte bez napięcia, umożliwiając gojenie podśluzówkowe implantu. Wargowy zarys wyrostka był bardziej wypukły niż przed augmentacją. Zaplanowano odsłonięcie implantów za 3 miesiące.
Podsumowanie
Spośród wielu dostępnych materiałów do augmentacji kości wybór odpowiedniego materiału jest trudny. Wybór powinien być podyktowany zakresem ubytku oraz celami terapeutycznymi.
Biorąc pod uwagę autogenne pochodzenie, korzystne kliniczne i histologiczne wyniki leczenia, przeszczep kostny pochodzenia zębowego powinien być zawsze brany pod uwagę, gdy ekstrakcja zębów jest konieczna.
Piśmiennictwo:
- Pashley D.H., Dentin: A dynamic substrate – A review. Scanning Microsc 1989; 3: 161–174.
- Murata M., Akazawa T., Mitsugi M., i wsp., Autograft of dentin materials for bone regeneration. W: Pignatello R. (red.). Advances in Biomaterials Sciences and Biomedical Applications. InTech, Croatia 2013.
- Smith A.J., Vitality of the dentin-pulp complex in health and disease: Growth factors as key mediators. J Dent Educ 2003; 67: 678–689.
- Yeomans J.D., Urist M.R., Bone induction by decalcified dentine implanted into oral, osseous and muscle tissues. Arch Oral Biol 1967; 12: 999–1008.
- Urist M.R., Strates B.S., Bone morphogenetic protein. J Dent Res 1971; 50: 1392–1406.
- Inoue T., Deporter D.A., Melcher A.H., Induction of cartilage and bone by dentin demineralized in citric acid. J Periodontal Res 1986; 21: 243–255.
- Feng J.Q., Luan X., Wallace J. i wsp., Genomic organization, chromosomal mapping, and promoter analysis of the mouse dentin sialophosphoprotein (Dspp) gene, which codes for both dentin sialoprotein and dentin phosphoprotein. J Biol Chem 1998; 273: 9457–9464.
- Ritchie H.H., Ritchie D.G., Wang L.H., Six decades of dentinogenesis research. Historical and prospective views on phosphophoryn and dentin sialoprotein. Eur J Oral Sci 1998; 106 Suppl 1: 211–220.
- Bessho K., Tanaka N., Matsumoto J. i wsp., Human dentin-matrix-derived bone morphogenetic protein. J Dent Res 1991; 70: 171–175.
- Murata M., Akazawa T., Mitsugi M. i wsp., Human dentin as novel biomaterial for bone regeneration. Biomaterials-Physics and Chemistry. In Tech 2011; 127–140.
- Murata M., Akazawa T., Hino J. i wsp., Bioche-mical and histo-morphometrical analyses of bone and cartilage induced by human decalcified dentin matrix and BMP-2. Oral Biol Res 2011; 35: 9–14.
- Park S.M., Um I.W., Kim Y.K. i wsp., Clinical application of auto-tooth bone graft material. J Korean Assoc Oral Maxillofac Surg 2012; 38: 2–8.
- Park S., Um I.W., Kim Y.K. i wsp., Clinical application of auto-tooth bone graft material. J Korean Assoc Oral Maxillofac Surg 2012; 38: 2–8.
- Kim Y.K., Kim S.G., Kim K.W. i wsp., Extraction socket preservation and reconstruction using autogenous tooth bone graft. J Korean Assoc Maxillafac Plast Reconstr Surg 2011; 33: 264–269.
- Murata M., Sato D., Hino J. i wsp., Acid-insoluble human dentin as carrier material for recombinant human BMP-2. J Biomed Mater Res A 2012; 100: 571–577.
- Lee J.Y., Kim Y.K., Kim S.G. i wsp., Histomorphometric study of sinus bone graft using various graft material. J Dent Rehabil Appl Sci 2011; 27: 141–147.
- Jeong K.I., Kim S.G., Kim Y.K. i wsp., Clinical study of graft materials using autogenous teeth in maxillary sinus augmentation. Implant Dent 2011; 20: 471–475.
- Chang H.Y., Kwon T.K., Nunn M.E. i wsp., Feasibility analysis of autogenous tooth-based bone graft material after guided bone regeneration technique. J Case Rep Stud 2014; 1: 1–7.