POLECAMY
Chemiczne opracowanie kanałów korzeniowych. Podstawowe środki płuczące
Na podstawie licznych badań udowodniono, że do chemicznego oczyszczenia systemu kanałów korzeniowych należy zastosować kilka środków płuczących, łącząc je przy tym w sensowną koncepcję terapeutyczną [1–3]. Obecnie do płukania jamy zęba najczęściej wykorzystuje się 2–5-procentowy roztwór podchlorynu sodu (NaOCl), 17-procentowy roztwór wersenianu sodu (EDTA) lub roztwór kwasu cytrynowego. Niektórzy autorzy zalecają również stosowanie chlorheksydyny (CHX), jednak konwencjonalne płukanie kanałów korzeniowych opiera się głównie na roztworach NaOCl i EDTA.
Podchloryn sodu (sól sodowa kwasu podchlorawego) jako środek do płukania kanałów korzeniowych został po raz pierwszy opisany w 1919 r. Jest jednym z najstarszych i najlepszych środków stosowanych w endodoncji, wykorzystywanym przede wszystkim w celu eliminacji mikroorganizmów zasiedlających system kanałowy [4–6]. Oprócz działania dezynfekującego NaOCl rozpuszcza martwą i żywą tkankę organiczną oraz wykazuje zdolność wybielania tkanek twardych zęba [1, 2].
Konieczność stosowania NaOCl podczas chemo-mechanicznego opracowania kanałów korzeniowych jest bezdyskusyjna. Od wielu lat toczy się natomiast spór na temat zalecanego stężenia NaOCl w dezynfekcji kanałów korzeniowych, a podawane wartości wahają się od 0,5% do 5,25% [7–10]. Według Huls-
manna rozsądnym rozwiązaniem, biorąc pod uwagę z jednej strony działanie antybakteryjne i lityczne NaOCl, z drugiej zaś jego toksyczność, jest stosowanie NaOCl w stężeniu 1–3% [2].
Według niektórych autorów większe stężenia NaOCl gwarantują jego większą efektywność antybakteryjną i lepszą zdolność rozpuszczania tkanki organicznej [11]. Inni badacze nie stwierdzili natomiast żadnych istotnych różnic w antybakteryjnym i litycznym działaniu roztworów NaOCl w stężeniu 1%, 2,5% oraz 5,25% a nawet 6% [12–14]. Należy również pamiętać, że skuteczność NaOCl zależy nie tylko od jego stężenia, ale także od temperatury, ilości oraz czasu działania środka płuczącego.
Podwyższenie temperatury, a tym samym wzrost efektywności NaOCl można uzyskać dzięki zastosowaniu pasywnej aktywacji ultra-
dźwiękami (PUI) lub urządzeniami dźwiękowymi [1, 2].
Podchloryn sodu ma również zdolność usuwania organicznej części warstwy mazistej. W celu usunięcia nieorganicznej części warstwy mazistej, do ostatecznego płukania kanałów można wykorzystać 17% roztwór EDTA lub roztwór kwasu cytrynowego [13].
Wersenian sodu (EDTA) jest związkiem biozgodnym, dobrze tolerowanym przez tkanki okołowierzchołkowe i wykazuje silne właściwości chelatujące. W przeciwieństwie do NaOCl, EDTA nie wykazuje działania przeciwbakteryjnego ani nie rozpuszcza tkanki organicznej [15, 16].
Kwas cytrynowy w endodoncji jest stosowany w stężeniu 40–50% i może być używany zamiast EDTA. Podobnie jak wersenian sodu, wykazuje zdolności chelatujące i usuwa nieorganiczną część warstwy mazistej. Wykazano również, że działa przeciwbakteryjnie, ale w zdecydowanie mniejszym stopniu niż roztwór NaOCl. Dlatego kwas cytrynowy nadal nie może stanowić jedynego środka płuczącego. Podobnie jak EDTA, należy stosować go w połączeniu z roztworem NaOCl.
Chlorheksydyna (CHX) to antyseptyk o silnym działaniu bakterio- a także wirusobójczym oraz przeciwgrzybiczym. Do płukania kanałów korzeniowych najczęściej wykorzystuje się jej 2-procentowy roztwór. Ze względu na udokumentowaną skuteczność CHX przeciwko E. faecalis zaleca się jej stosowanie podczas powtórnego leczenia kanałowego. Mimo silnego działania przeciwbakteryjnego nie poleca się jednak rutynowego zastępowania CHX roztworu NaOCl. Wynika to z faktu, że roztwór CHX nie rozpuszcza tkanki organicznej i nie usuwa warstwy mazistej. Poza tym, mimo że CHX jest skuteczna w eliminowaniu bakterii Gram-dodatnich i Candida albicans, jest mniej aktywna w stosunku do bakterii Gram-ujemnych, a te dominują przy pierwotnych zapaleniach miazgi. Chlorheksydyna jest zalecana jako preparat uzupełniający, a nie podstawowy przy leczeniu kanałowym [1].
Należy przy tym zaznaczyć, że nigdy nie można stosować roztworu chlorheksydyny bezpośrednio po roztworze podchlorynu sodu!
Wynika to z faktu istnienia silnych interakcji między tymi dwoma środkami płuczącymi. Jeśli w kanale znajdują się nawet nieznaczne ilości NaOCl, CHX wchodzi z nim w reakcję i wytrąca się brunato-pomarańczowy osad. Może to mieć wpływ na późniejsze przebarwienie korony zęba, a nawet pogarszać szczelność wypełnienia kanałowego. Jest jeszcze jeden niepożądany efekt ww. interakcji: wytrącający się osad zawiera m.in. parachloroanilinę (PCA), która jest substancją toksyczną i karcinogenną.
Przed wprowadzeniem do kanału CHX należy więc dokładnie wypłukać z niego roztwór NaOCl. Można to zrobić, używając dużych ilości EDTA, soli fizjologicznej lub alkoholu.
Podchloryn sodu wchodzi również w bardziej znaną interakcję z wodą utlenioną. Połączenie tych dwóch płynów skutkuje powstaniem tlenu cząsteczkowego i obfitym pienieniem. To zjawisko może być korzystne tylko w przypadku konieczności usunięcia z kanału niepożądanych elementów, np. fragmentów złamanego narzędzia. W innej sytuacji nie znajduje teoretycznego i praktycznego zastosowania. Zadaniem NaOCl jest rozpuszczanie tkanki organicznej i niszczenie drobnoustrojów. Tymczasem woda utleniona staje się niejako „konkurencją” dla miazgi i bakterii i wchodząc w reakcję z NaOCl, osłabia jego zdolności lityczne i antybakteryjne [1].
Mając na uwadze wzajemne oddziaływania środków płuczących, można zaproponować następujący schemat ostatecznego płukania kanałów korzeniowych:
NaOCl (z agitacją np. urządzeniami dźwiękowymi),
wersenian sodu (EDTA) lub roztwór
kwasu cytrynowego,
ewentualnie ponownie podchloryn sodu (według niektórych autorów może w tej sytuacji lepiej penetrować w kanaliki zębinowe),
sól fizjologiczna lub alkohol [17].
Do płukania kanałów korzeniowych należy używać odpowiedniego instrumentarium. Zaleca się stosowanie strzykawek typu Luer-Lock oraz igieł endodontycznych, a nie zwykłych igieł iniekcyjnych. Zwiększa to bezpieczeństwo pracy i minimalizuje ryzyko przedostania się środków płuczących poza kanał korzeniowych. Dodatkowo igły endodontyczne mają mniejszą średnicę niż tradycyjne igły iniekcyjne i dzięki temu można je wprowadzić głębiej do kanału i efektywniej oczyścić chemicznie jamę zęba.
Należy również pamiętać, aby nie wprowadzać igły do kanału zbyt głęboko.
W tym celu głębokość wprowadzenia należy oznaczyć np. gumowym ogranicznikiem. Igłę wprowadza się na głębokość ok. 2 mm krótszą od długości roboczej.
Jak zwiększyć skuteczność działania środków płuczących?
Aby zwiększyć efektywność działania środków płuczących, zaleca się ich agitację, np. za pomocą fal ultradźwiękowych.
Aktywacja środków płuczących za pomocą fal ultradźwiękowych
Ultradźwięki to fale akustyczne o częstotliwości 20–40 tys. Hz, a więc powyżej progu słyszalności ucha ludzkiego. Fale ultradźwiękowe są przesyłane z urządzenia do zęba poprzez odpowiednie narzędzie kanałowe, np. ultradźwiękowy pilnik K zamontowany w uchwycie skalera ultradźwiękowego. W zależności od źródła fal urządzenia ultradźwiękowe można podzielić na magnetostrykcyjne i piezoceramiczne. Przedstawicielami urządzeń ultradźwiękowych są m.in.: Satelec P5Booster, Piezon Master, Cavi-Endo [18].
Zalety stosowania płukania ultradźwiękowego
Stosowanie ultradźwięków powoduje podgrzewanie środków płuczących oraz zapewnia wprowadzenie większej ilości świeżego roztworu do kanału w jednostce czasu. Duża skuteczność płukania kanałów korzeniowych przy wykorzystaniu energii ultradźwiękowej jest uwarunkowana także występowaniem zawirowań akustycznych oraz kawitacji [19].
Zawirowania akustyczne to silne zawirowania wokół narzędzia pracującego wywołane wibracjami ultradźwiękowymi.
Dzięki zawirowaniom akustycznym oczyszczane są zachyłki, kanały boczne, rozgałęzienia delty korzeniowej, kanaliki zębinowe, ziarnina w przypadku resorpcji wewnętrznej oraz część przywierzchołkowa kanału z zalegających tam opiłków zębiny.
Kawitacja to efekt implozji pęcherzyków (bąbelków powietrza) w obrębie środka płuczącego. Uwolniona w ten sposób energia może doprowadzić do uszkodzenia komórek bakteryjnych.
W wielu doświadczeniach wykazano, że ultradźwiękowe płukanie kanałów korzeniowych w znaczny sposób przyczynia się do redukcji bakterii, przyspiesza rozpuszczanie tkanki organicznej oraz poprawia oczyszczenie jamy zęba z resztek miazgi i opiłków zębiny [20–24].
Zasady pracy podczas ultradźwiękowego płukania kanałów korzeniowych
Stosując ultradźwiękowe płukanie kanałów korzeniowych, należy pamiętać o właściwym doborze pilnika do światła kanału. Pilnik musi być na tyle mały, aby nie kontaktował ze ścianami kanału i swobodnie poruszał się w płynie. Tylko wtedy można uzyskać optymalne działanie PUI, przy jednoczesnej redukcji możliwych powikłań, takich jak wytworzenie stopnia czy złamanie pilniczka.
Narzędzia ultradźwiękowe wprowadza się zawsze w spoczynku, a aparat włącza się dopiero po osiągnięciu przez pilniczek określonej głębokości w kanale (przy płukaniu jest to ok. 2 mm mniej od długości roboczej).
Długość, na jaką należy wprowadzić pilniczek, należy na nim zaznaczyć np. wodoodpornym flamastrem. Nie należy w tym celu stosować ogra-
niczników silikonowych, ponieważ hamują one przepływ środka płuczącego.
Pilniczkiem można wykonywać ruchy góra–dół, ale nie należy przekraczać wyznaczonej głębokości wprowadzenia.
Proponowany czas przeprowadzania pasywnego płukania ultradźwiękowego wynosi 10 sekund, 30 sekund, 3 minuty, w zależności od techniki aplikacji płynu.
Często zalecanym schematem płukania kanałów korzeniowych przy użyciu ultradźwięków jest tzw. metoda przerywanego przepływu środka płuczącego: 1 minuta płukania na kanał z trzema 20-sekundowymi aktywacjami i z trzykrotną wymianą roztworów NaOCl oraz EDTA. Skuteczność tej techniki udowodnili w swoich publikacjach m.in. van der Sluis [19] oraz Kuah i wsp. [23].
Alternatywy dla płukania ultradźwiękowego – urządzenia dźwiękowe
W przypadku niedysponowania skalerem ultradźwiękowym można wykorzystać inne metody aktywacji środków płuczących, m.in. urządzenia dźwiękowe, takie jak: EndoActivator®, Rispisonic®, Helisonic® i Endosonic®.
Urządzenia dźwiękowe pracują z częstotliwością 3000–8000 Hz. Wibracje powstałe w wyniku działania tych końcówek są więc mniejsze niż w urządzeniach ultradźwiękowych, ale w piśmiennictwie nie ma jednoznacznego poglądu na temat wyższości stosowania fal ultradźwiękowych nad dźwiękowymi w dezynfekcji systemu kanałowego.
Aktywacja środków płuczących za pomocą narzędzi dźwiękowych zostanie przedstawiona na przykładzie urządzenia EndoActivator®.
Jak wcześniej wspomniano, EndoActivator® opiera się na zastosowaniu energii fal dźwiękowych. Końcówki Activator stosuje się wraz z kątnicą Driver, która zapewnia energię potrzebną do uzyskania oscylacji i wibracji końcówki. Aktywacja płynu sprzyja głębokiemu oczyszczaniu i dezynfekcji kanałów bocznych, rozgałęzień, sieci kanalików i ich zespoleń. Oczyszczenie systemu kanałów korzeniowych ułatwia również ich trójwymiarowe wypełnienie.
Z czego składa się i jak działa EndoActivator®?
Zasady bezpieczeństwa pracy:
System EndoActivator® składa się z kątnicy EndoActivator® oraz zestawu końcówek Activator o różnych rozmiarach. W skład oryginalnego zestawu wchodzi również rękaw ochronny. Wszystkie procedury endodontyczne należy wykonywać przy użyciu rękawa ochronnego EndoActivator® założonego na kątnicę.
W celu uniknięcia zakażenia krzyżowego, końcówki EndoActivator® i folię ochronną należy używać jednorazowo. Aby nie zakazić systemu kanałowego, końcówki EndoActivator® powinny być odkażone przed użyciem.
Kątnica może pracować w trzech trybach (high, med., low). Wybór poszczególnego trybu zależy od danej procedury, doświadczenia lekarza oraz zasilania, jakie jest potrzebne do skutecznego wykonania leczenia.
Uwaga:
Po włączeniu urządzenie domyślnie ustawione zostaje na wysokie obroty (high). Aby wybrać średnią (med.) lub niską (low) prędkość, należy nacisnąć trójstopniowy przełącznik.
Instrukcja pracy urządzeniem EndoAcitvator® krok po kroku
- Opracuj kanał w kształcie stożka, czyli tak, jak zaleca się w zdecydowanej większości przypadków leczenia kanałowego
- Wypełnij jamę zęba płynem NaOCl, EDTA lub innym roztworem przeznaczonym do płukania.
- Wybierz końcówkę Activator, którą można swobodnie ręcznie wprowadzić na głębokość o 2 mm krótszą od długości roboczej.
- Kątnicę pokryj rękawem ochronnym na całej jej długości.
- Do kątnicy osłoniętej rękawem ochronnym przymocuj końcówkę Activator. Końcówka Activator powinna „wskoczyć” w otwór, zapewniając dokładne połączenie z kątnicą.
- Wprowadź końcówkę Activator zamocowaną w kątnicy do opracowanego kanału korzeniowego.
- Aby włączyć urządzenie, naciśnij przełącznik on/off.
- Przesuwaj kątnicę lub końcówkę Activator krótkimi ruchami posuwistymi o zakresie 2–3 mm.
- Aktywuj środek płuczący przez ok. 30–60 sekund.
- Ponownie wypłucz kanały, używając np. strzykwki z igłą endodotyczną z otworkiem z boku, po czym osusz kanały sączkami papierowymi.
Po zakończeniu zabiegu zdejmij zamocowaną końcówkę, chwytając i pociągając palcami za dużą, okrągłą część ochronną końcówki Activator. Zdejmij końcówkę Activator z kątnicy, mocno przytrzymując zagiętą szyjkę kątnicy. Następnie zdejmij i wyrzuć rękaw ochronny.
Zdejmowanie końcówki Activator
Mocno przytrzymaj główkę kątnicy kciukiem, jednocześnie chwytając kciukiem i palcem wskazującym drugiej ręki za biały okrągły kołnierz końcówki Activator.
Przytrzymując mocno kciukiem kątnicę, pociągnij za końcówkę Activator. Podczas zdejmowania końcówka Activator oraz główka kątnicy powinny znajdować się w jednej linii. Końcówkę Activator można zakładać i zdejmować wyłącznie przy takim dokładnie ustawieniu. Podczas zdejmowania końcówki nigdy nie skręcaj i nie obracaj jej zgodnie ani przeciwnie do ruchu wskazówek zegara.
Jeśli lekarz dentysta nie dysponuje żadnym urządzeniem do agitacji środków płuczących, ostatecznie można do tego celu użyć ćwieka gutaperkowego i wielokrotnie poruszać nim w NaOCl umieszczonym w kanale korzeniowym. Wiele publikacji naukowych donosi, że nawet taka agitacja NaOCl jest lepsza od zwykłego płukania kanałów strzykawką z igłą.
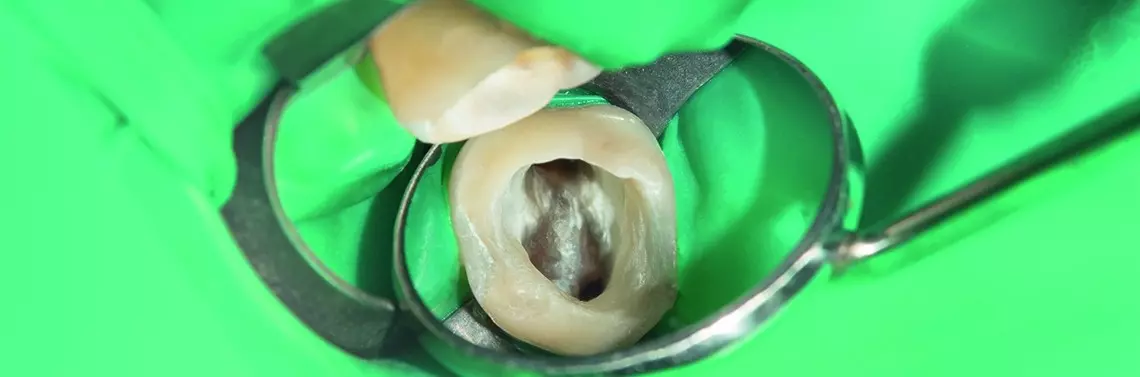
Warstwa mazista
Warstwa mazista (ang. smear layer) powstaje podczas biomechanicznego opracowania kanału korzeniowego i składa się z organicznego oraz nieorganicznego materiału, w tym z resztek zębiny, pozostałości włókien odontoblastów, żywej lub obumarłej miazgi, fosforanów wapnia i mikroorganizmów [25–27].
Poglądy na temat pozostawienia lub eliminacji warstwy mazistej są podzielone.
Niektórzy badacze nie zaobserwowali związku w szczelności wypełnień kanałowych w zależności od usunięcia lub pozostawienia warstwy mazistej. Inni napisali, że obecność tej warstwy wręcz polepsza szczelność wypełnień (te badania są w mniejszości). Rozbieżności w otrzymanych wynikach doświadczeń wynikają przede wszystkim z różnych metod badań (różne materiały i metody wypełnienia kanałów, inne
sposoby usuwania warstwy mazistej) [28–30].
W świetle większości badań warstwa mazista jest przedstawiana jako warstwa zanieczyszczeń, którą należy usunąć przed ostateczną obturacją jamy zęba [31–36]. Warstwa mazista jest siedliskiem drobnoustrojów i magazynem ich pożywki w postaci licznych związków organicznych [25]. Bakterie pozostawione w warstwie mazistej mogą przyczynić się do reinfekcji kanału oraz wywołać lub podtrzymywać procesy patologiczne w tkankach okołowierzchołkowych. Na podstawie badań przeprowadzonych w mikroskopie skaningowym stwierdzono również lepszą adhezję materiału wypełniającego kanał i istotnie głębsze zapływanie uszczelniaczy w światło otwartych kanalików zębinowych po usunięciu warstwy mazistej [37–39]. W badaniu opublikowanym przez Clark-Holke i wsp. [31], w grupie kanałów, w których usunięto warstwę mazistą, nie zaobserwowano żadnego przypadku penetracji bakterii (0/10 zębów). W grupie kanałów, w których pozostawiono warstwę mazistą, przeciek bakteryjny pojawił się w 6 z 10 badanych próbek. Autorzy do obturacji zębów siecznych szczęki wykorzystali metodę bocznej kondensacji zimnej gutaperki i uszczelniacz
AH 26®. Również Cobancara i wsp. [40] wykazali znacznie mniejszy przeciek koronowy i wierzchołkowy (na podstawie wyników testu przepływu płyn w grupie kanałów, w których przed obturacją usunięto warstwę mazistą). W przytaczanym badaniu zastosowano uszczelniacze na bazie żywic epoksydowych lub polidimetylosiloksanu. Na uwagę zasługuje również fakt, że usunięcie warstwy mazistej polepszyło szczelność wypełnień kanałowych wykonanych zarówno metodami zimnej, jak i ciepłej gutaperki [41–43].
W związku z tym, że warstwa mazista składa się zarówno z komponenty organicznej, jak i nieorganicznej, do jej usunięcia należy użyć płynów rozpuszczających te dwa różne rodzaje związków. Najczęściej wykorzystywane są do tego celu roztwór NaOCl oraz EDTA lub kwas cytrynowy.
Piśmiennictwo
- Arabska-Przedpełska B., Pawlicka H. Współczesna endodoncja w praktyce. Bestom Dentonet.pl 2011.
- Hulsmann M. Die Desinfektion des endodotischen Systems. Endodontie 2006; 15: 147–168.
- Zehnder M., Kosicki D., Luder H., Sener B., Waltimo T. Tissue-dissolving capacity and antibacterial effect of buffered and unbuffered hypochlorite solutions. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002; 94: 756–762.
- Dunavant T.R., Regan J.D., Glickman G.N., Solomon E.S., Honeyman A.L. Comparative Evaluation of Endodontic Irrigants against Enterococcus faecalis Biofilms J Endod 2006; 32: 527–531.
- Ferguson J.W., Hatton, J.F., Gillespie M.J. Effectiveness of Intracanal Irrigants and Medications against the Yeast Candida albicans. J Endod 2002; 28: 68–71.
- Hongyan L., Xi W., Junqi L., Wang W., Xiangya H. Biofilm formation capability of Enterococcus Faecalis cells in starvation phase and its susceptibility to sodium hypochlorite
- J Endod 2010; 36: 630–635.
- Hand R.E., Smith M.L, Harrison J.W. Analysis of the effect of dilution on the necrotic tissue dissolution property of sodium hypochlorite. J Endod 1978; 4: 60–64.
- Zehnder M. Root canal irrigans. J Endod 2006; 32: 389–398
- Sim T.P., Knowles J.C., Ng Y.L., Shelton J., Gulabivala K. Effect of sodium hypochlorite on mechanical properties of dentine and tooth surface strain. Int Endod J 2001; 34: 120–132.
- Spangberg L., Engstrom B., Langeland K. Biologic effects of dental materials: toxicity and antimicrobial effect of endodontic antiseptics in vitro. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1973; 36: 856–871.
- Clegg M.S., Vertucci F.J., Walker C., Belanger M., Britto L.R. The Effect of Exposure to Irrigant Solutions on Apical Dentin Biofilms In Vitro. J Endod 2006; 32: 434–437.
- Dunavant T.R., Regan J.D., Glickman G.N., Solomon E.S., Honeyman A.L. Comparative evaluation of endodontic irrigants against Enterococcus faecalis biofilms. J Endod 2006; 32: 527–531.
- Siqueira J.F., Rôças I.N., Favieri A., Lima K.C. Chemomechanical Reduction of the Bacterial Population in the Root Canal after Instrumentation and Irrigation with 1%, 2.5%, and 5.25% Sodium Hypochlorite. J Endod 2000; 26: 331–334.
- Spratt D.A., Pratten J., Wilson M., Gulabivala K. An in vitro evaluation of the antimicrobial efficacy of irrigants on biofilms of root canal isolates. Int Endod J 2001; 34: 300–307.
- De-Deus G., Soares J., Fernanda L., Aderval S., Fidel S.F., Rivail A. Similar Glucose Leakage Pattern on Smear-covered, EDTA-treated and BioPure MTAD-treated Dentin. J Endod 2008; 34: 459–462.
- Hulsmann M. Die Desinfektion des endodotischen Systems. Endodontie 2006; 15: 147–168.
- Bargholz C., Hor D., Zirkel Ch. Endodoncja. Wydawnictwo Urban & Partner, Wrocław 2006.
- Korzeniewska P. Wykorzystanie ultradźwięków w leczeniu kanałowym. Magazyn Stomatologiczny 2002; 124: 30–33.
- Van der Sluis L. Die Passive Ultraschallspullung des Wurzelkanalsystem. Endodontie 2006; 15: 177–185.
- Burleson A., Nusstein J., Reader A., Beck M. The In Vivo Evaluation of Hand/Rotary/Ultrasound Instrumentation in Necrotic, Human Mandibular Molars. J Endod 2007; 33: 782–787.
- Gutarts R., Nusstein J., Reader A., Beck M. In Vivo Debridement Efficacy of Ultrasonic Irrigation Following Hand-Rotary Instrumentation in Human Mandibular Molars. J Endod 2005; 31: 166–170.
- Huque J., Kota K., Yamaga M., I Waku M., Hoshino E. Bacterial eradication from root dentine by ultrasonic irrigation with sodium hypochlorite. Int Endod J 1998; 31: 242–250.
- Kuah H.G., Lui J.N., Patrick S.K., Chen N.N. The Effect of EDTA with and without Ultrasonics on Removal of the Smear Layer. J Endod 2009; 35: 393–396.
- Weber C.D., McClanahan S.B., Miller G.A., Diener-West M., Johnson J.D. The effect of passive ultrasonic activation of 2% chlorhexidine or 5.25% sodium hypochlorite irrigant on residual antimicrobial activity in root canals. J Endod 2003; 29: 562–564.
- Arabska-Przedpełska B., Pawlicka H. Endodoncja. Morfologia. Diagnostyka. Leczenie. Med Tour Press International Wydawnictwo Medyczne. Warszawa 2004 .
- Barańska-Gachowska M. Endodoncja wieku rozwojowego i dojrzałego. Wydawnictwo Czelej, Lublin 2004.
- Bargholz C., Hor D., Zirkel Ch. Endodoncja. Wydawnictwo Elsevier Urban & Partner, Wrocław 2007.
- Timpawat S., Sripanaratanakul S. Apical Sealing Ability of Glass Ionomer Sealer with and without Smear Laye. J Endod 1998; 24: 343–345.
- Timpawat S., Vongsavan N., Messer H. A comparison of effect of removal of the smear layer on apical microleakage. J Endodon 2001; 27: 351–353.
- Froes J., Horta HG., da Silveira A.B. Smear layer influence on the apical seal of four different obturation techniques. J Endod 2000; 26: 351–354.
- Clark-Holke D., Drake D., Walton R., Rivera E., Guthmiller J.M. Bacterial penetration through canals of endodontically treated teeth in the presence or absence of the smear layer. J Dent 2003; 31: 275–281.
- Gencoglu N. Dentinal wall adaptation of thermoplasticized gutta-percha in the absence or presence of smear layer: a scanning electron microscopic study. J Endod 1993; 19: 558–562.
- Gencoglu N. Evaluation of sealing properties of Thermafil and Ultrafil techniques in the absence or presence of smear layer. J Endod 1993;19: 599–603.
- Saleh I.M., Ruyter I.E., Haapasalo M., Ørstavik D.
- Bacterial penetration along different root canal filling materials in the presence or absence of smear layer. Int Endod J 2008; 41: 32–40.
- Saunders E.M. In vivo findings associated with heat generation during thermomechanical compaction of gutta-percha. 2. Histological response to temperature elevation on the external surface of the root. Int Endod J 1990; 23: 268–274.
- White R.R., Goldman M., Lin P. The influence of the smeard layer upon dentinal tubule penetration by plastic filling materials. J Endod 1984; 10: 558–562.
- Gutmann J.L., Saunders W.P., Saunders E.M., Ngueyen L. An assessment of the plastic Thermafil obturation technique: Part 1 Radiographic evaluation of adaptation and placemen. Int Endod J 1993; 26: 173–178.
- Holland R., Sakashita M.S., Murata S.S., Junior E.D. Effect of dentine surface treatment on leakage of root canal fillings with a glass ionomer cement sealer. Int Endod J 1995; 28: 190–193.
- Kokkas A.B., Boutsioukis A., Vassiliadis L.P., Stavrianos Ch.K. The Influence of the Smear Layer on Dentinal Tubule Penetration Depth by Three Different Root Canal Sealers: An In Vitro Study.
- J Endod 2004; 30: 100–102.
- Çobankara F.C., Adanir N., Belli S. Evaluation of the influence of smear layer on the apical and coronal sealing ability of two sealers. J Endod 2004; 30: 406–409.
- Gutmann J.L. Adaptation of injected thermoplasticized gutta-percha in the absence of the dentinal smear layer. Int Endod J 1993; 26: 87-92.
- Taylor J.K., Jeansonne B.G., Lemon R.R. Coronal leakage: Effects of smear layer, obturation technique, and sealer. J Endod 1997; 23: 508–512.
- Von Fraunhofer J.A., Fagundes D.K., McDonald N.J., Dumsha T.C. The effect of root canal preparation on microleakage within endodontically treated teeth: an in vitro study. Int Endod J 2000; 33: 355–360.