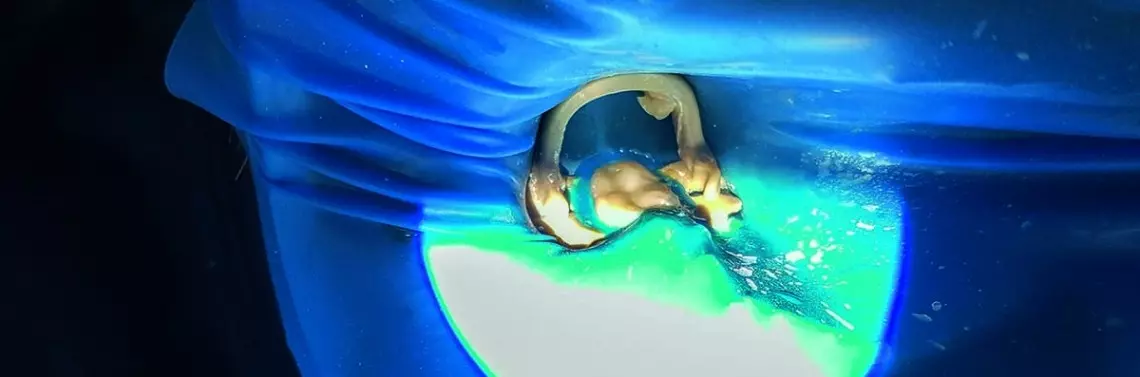
Jednymi spośród najczęściej występujących torbieli są torbiele zapalne korzeniowe (ang. cystis radicularis). Zmiany te mają kształt kulisty w żuchwie i owalny w szczęce, ze względu na różnice anatomiczne w budowie tych kości. Torbiele, których wielkość nie prowadzi do zniekształceń w obrębie kości, nie dają charakterystycznych objawów bólowych. Torbiele większych rozmiarów deformują struktury kostne oraz wywierając ucisk na pozostałe struktury anatomiczne, powodują resorbcję kości wyrostka zębodołowego [1].
Sugerowane leczenie torbieli polega na radykalnym usunięciu mieszka torbieli wraz z całą zawartością [2], jednakże mikroprzeciek bakteryjny przenikający z jamy ustnej może spowodować powstanie nowych zmian [3].
Cyfrowa stomatologia to zespół narzędzi umożliwiających szybszą pracę, większą dokładność oraz redukcję kosztów. Poszczególne składowe, takie jak skanery oraz technologia CAD-CAM (ang. computer aided design-computer aided maufacturing) są już obecne w praktyce stomatologicznej lub, tak jak druk 3D, są stopniowo wprowadzane i doskonalone. Pozostałe, jak chociażby poszerzona rzeczywistość (ang. augmented reality), są obecnie tylko koncepcyjne [4]. Niemniej podnoszenie kwalifikacji zawodowych oraz chęć przedstawienia pacjentowi najlepszych opcji leczenia skłania lekarza stomatologa do zapoznania się z nowymi możliwościami postępowania.
Druk 3D w technologii DLP (ang. digital light processing) umożliwia wykonanie modeli orientacyjnych, modeli medycznych z obrazów tomografii komputerowej wiązką stożkową (ang. cone beam computed tomography – CBCT), szablonów chirurgicznych, szyn relaksacyjnych, tymczasowych odbudów pełnołukowych, wielo-
lub jednopunktowych.
POLECAMY
Opis przypadku
Pacjent, lat 31, został oddelegowany z obcego gabinetu celem diagnostyki oraz leczenia zmiany w rejonie zęba 46. Pacjent zgłaszał dolegliwości bólowe, co mogło być spowodowane uciskiem na kanał nerwu zębodołowego dolnego [5]. Ząb w badaniu klinicznym wykazał całkowity brak ruchomości, koronę ze znacznie zredukowanymi tkankami własnymi oraz z nieszczelnymi wypełnieniami. Na podstawie dostarczonego badania CBCT (tomografia komputerowa stożkowa) stwierdzono zmianę okołowierzchołkową obejmującą oba wierzchołki zęba 46. oraz furkację z perforacją wkładem typu anker. Biorąc pod uwagę masywną utratę tkanek koronowych – bez możliwości przewidywalnej odbudowy, perforację w furkacji, oraz pokaźną zmianę obejmującą ponad połowę długości korzeni, podjęto decyzję o usunięciu zmiany. Problem stanowiła prawdopodobna ankyloza pozapalna korzeni umiejscowiona mezjalnie i dystalnie, która mimo separacji mogłaby skutkować odłamaniem wysokich i mocno odśrodkowo zresorbowanych ścianek kortykalnych. Spowodowałoby to deficyt tkanek podczas odbudowy braku zębowego i prawdopodobną konieczność GBR. Dodatkową trudność stanowiły bliskość nerwu zębodołowego oraz korzeni sąsiednich zębów. Z tych powodów podjęto decyzję o tymczasowym utrzymaniu zęba 46., mimo wątpliwego rokowania [6].
W toku planowania leczenia oraz w celu przedstawienia problemu pacjentowi po wykonaniu badania tomografii komputerowej (TK) plik w formacie DICOM przetworzono przez oprogramowanie 3D (InVesalius 3.1), tworząc trójwymiarowy model anatomiczny, na podstawie którego zaprojektowano model [7]. Model ten wykonano metodą stereolitografii w technologii DLP z użyciem drukarki Anycubic Phrozen i żywicy Monocure 3D Rapid [8].
Postanowiono wykonać leczenie interdyscyplinarne, które rozpoczęło się usunięciem starych wypełnień z obszaru korony, odbudową zęba do I klasy oraz usunięciem w powiększeniu wkładu z kanału perforacji. Po tych krokach usunięto tkanki zdemineralizowane z obrębu perforacji wraz z odessaniem zawartości w postaci wysięku ropnego – przeprowadzono płukanie H2O2 oraz solą fizjologiczną, a ubytek tymczasowo zaopatrzono. Podczas kolejnej wizyty po 7 dniach otrzymano informację o mniejszej symptomatyczności zęba. Po usunięciu materiału tymczasowego ubytek w części koronowej oraz zmiana były wypełnione opalizującym płynem, co poniekąd potwierdzało wcześniejsze przypuszczenia co do klasyfikacji zmiany jako torbieli. Po płukaniu zmiany metronidazolem zamknięto perforację za pomocą MTA (MTA Cerkamed) na gąbce kolagenowej, pokrytych GJ oraz materiałem kompozytowym. Ząb został wyłączony z funkcji.
Następnie wykonano cięcie w girlandzie dziąsłowej oraz cięcie uwalniające na wysokości zęba 44., po czym odwarstwiono płat pełnej grubości. Cystektomia z dostępu bocznego za pomocą piezotomu (NSK-Nakanishi Variosurg), z resekcją wierzchołków korzeniowych została wykonana z wstecznym opracowaniem UD oraz wypełnieniem MTA [9, 10]. Ubytek wypełniono ksenograftem (Ti-oss Chiyewon), a następnie pokryto go membraną kolagenową (Collagene AT Sistema AT) i płatem pełnej grubości. Po ustąpieniu obrzęku pozabiegowego odnotowano brak bólu oraz przeczulicy. Badanie histopatologiczne potwierdziło rozpoznanie zmiany jako torbieli korzeniowej. Pacjent zgłosił się do zdjęcia szwów po 10 dniach, a następnie nie pojawił się przez 5 miesięcy.
Po tym czasie pacjent ponownie zgłosił się do gabinetu ze względu na chęć kontynuowania leczenia – w projekcji zęba 46. widoczne było przejaśnienie, które po wykonaniu nowego badania CBCT okazało się zmianą zapalną spowodowaną rozszczelnieniem odbudowy lub – co bardziej prawdopodobne –przeciekiem bakteryjnym pomiędzy furkacją resztek koronowych zęba a wyrostkiem kostnym. Zmiana była ograniczona w stosunku do zmiany pierwotnej, asymptomatyczna. Podjęto decyzję o ekstrakcji. Pobrano wycisk łuku zębowego żuchwy, na podstawie którego po skanowaniu został wygenerowany model wirtualny. Po optymalnym spozycjonowaniu implantu na podstawie tomografii i naniesieniu nań modelu łuku zębowego, na jego podstawie wygenerowano szablon chirurgiczny (Blue sky bio, Blue sky plan). Szablon został wydrukowany na wcześniej wspomnianej drukarce Anycubic Phrozen za pomocą biokompatybilnej żywicy Nexdent SG.
Po znieczuleniu pacjenta usunięto pozostałość zęba, wyłyżeczkowano zmianę wraz z porcją luźnego zainfekowanego graftu z poprzedniego zabiegu. Całość płukano roztworem metronidazolu o stężeniu 5%, a następnie wprowadzono po szablonie implant ICX ze stabilizacją 30 Ncm. Dzięki krwi własnej pacjenta pobranej z żyły powierzchownej dołu łokciowego po odwirowaniu uzyskano fibrynę bogatopłytkową (L-PRF), dwa produkty powstałe po procesie wirowania zmieszano z ksenograftem (stickybone) i wypełniono nim ubytki kostne. Po częściowej mobilizacji płata od strony policzkowej i pokryciu ubytku kolejnymi dwoma membranami L-PRF crestalnie wszystko szczelnie zszyto. Po 10 dniach przeprowadzono kontrolę ze zdjęciem szwów. Kontrola kliniczna oraz radiologiczna (OP) wskazała na prawidłowe gojenie z brakiem ogniska zapalnego.
Po 6 miesiącach od zabiegu implantacji pacjent zgłosił się na wizytę kontrolną, została także założona śruba gojąca. Po okresie gojenia tkanek miękkich oraz ich maturacji pobrano wycisk metodą łyżki otwartej. Następnie oddano pracę pełnokonturową z tlenku zirconu, cementowaną do łącznika typu Tibase przez technika. Praca przykręcana; po osadzeniu w ustach pacjenta zamaskowano otwór techniczny materiałem kompozytowym i skorygowano do występującej okluzji.

















do tomografii skanem modelu żuchwy














widoczna na obrazie RTG



Podsumowanie
Mimo wątpliwego rokowania zębów z niegojącymi się zmianami OKW podjęto decyzję o próbie usunięcia symptomatycznych zmian. Czynnikami decydującymi były młody wiek pacjenta, bardzo dobra higiena oraz stosunkowo niewielka utrata twardych tkanek koron zębów. Dzięki zastosowaniu druku 3D możliwym stało się dokładne zaplanowanie zabiegu oszczędzającego zdrowe tkanki, dostęp minimalizujący ryzyko powikłań oraz przykrych odczuć pozabiegowych. Zastosowanie materiału biologicznego do zaopatrzenia znacznego ubytku kostnego zostało podjęte w celu odtworzenia dobrych warunków kostnych jako bardziej przewidywalne, aniżeli pozostawienie ubytku bez augmentacji [11, 12]. Połączenie nawigacji 3D wraz z konwencjonalnym zabiegiem mikrochirurgicznym skutkowało powodzeniem terapeutycznym w okresie obserwacji oraz, mimo powikłań umożliwiło późniejsze zaopatrzenie braku zębowego implantoprotetycznie.
Piśmiennictwo
- Jańczuk Z., Kaczmarek U., Lipski M., Arabska-Przedpełska B. Stomatologia zachowawcza. Wydawnictwo Lekarskie PZWL, Warszawa 2010; 382–385.
- Kryst L i wsp. Chirurgia szczękowo-twarzowa. Wydawnictwo Lekarskie PZWL, Warszawa 2012; 276–281.
- Arabska-Przedpełska B., Pawlicka H. (red.). Współczesna endodoncja w praktyce. Dentonet, Łódź 2012, 405–408.
- Irfan M., Alauddin M., Roselinda A. i wsp. Big radicular cyst in a 12-year old girl: a case report. Int Med J, 2007, 6: C5
- Cawood S., Fiala M. Augmented reality: a practical guide. Pragmatic Programmers 2008; 1: 22–25.
- Żarow M. Endoprotetyka. Kwintesencja, Warszawa 2013; 298–300.
- Nowicki A., Jagucka-Mętel W., Sobolewska E. Drukarki 3D – możliwości zastosowania w praktyce stomatologicznej. Magazyn Stomatologiczny 2015; 74–76.
- Salmi M. Medical applications of additive manufacturing in surgery and dental care. School of Engineering 2013; 3: 28–32.
- Aqrabawi J. Sealing ability of amalgam super EBAcement and MTA when used as retrograde filling materials. Br Dent J 2000, 188: 266–268
- Marek E., Kot K., Bendyk-Szeffer M., Lipski M. MTA i Biodentine jako materiały do wstecznego wypełnienia kanału korzeniowego. Badanie w elektronowym mikroskopie skaningowym. Art Dent 2017; 66: 211–215.
- Dominiak M., Lysiak-Drwal K., Gedrange T. i wsp. Efficacy of healing process of bone defects after apectomy: results after 6 & 12 months. J Physiol Pharmacol 2009; 60: 51–55.
- Yoshikawa G., Murashima Y., Wadachi R. i wsp. Guided bone regeneration using membranes and calcium sulphate after apicectomy: a comparative histomorphometrical study. Int Endod J 2002; 35: 255–263